東工大 物質理工学院 材料系 H30年度(31大修) I-05 物理化学

【1】東京工業大学大学院 物質理工学院の過去問を自身の勉強のために解いたものです。
【2】必ずしも解答を保証するものではありせん。間違いがある場合があります。
【3】過去問は各自で手に入れてください。
[A] (1) 水に電流を流して蒸発させた際の計算問題
①Hm=40.5 [kJ/mol], ②dU=37.4 [kJ/mol], ③dHm=1500 [J]
解説:
①モルエンタルピーHmの単位は[J/mol]であり、1AVs=1Jであるから、水の分子量18 [g/mol]を用いて以下のように計算できる。

※各単位のおさらい:A=C/s, V=J/C
②エンタルピーHとは経路関数である熱を状態関数で表すために用いられる関数であり、定義はH≡U+PinVである。従って、内部エネルギー変化dU=dH-PinVであり、理想気体においては気体の状態方程式(PV=nRT)を用いて「dU=dH-nRT」と整理できる。1 [mol]での内部エネルギー変化は①の答えと与えられたRTの数値を用いて以下のように計算する。
dUm=dHm-RT=40.5-3.1=37.4 [kJ/mol]
※1 [mol]よりH→Hm, nRT→RT (n=1)と記載している。
③定圧熱容量Cp=(∂H/∂T)pより、定圧時のモルエンタルピー変化dHmは問題文より与えられたCpと温度変化を用いて以下のように計算できる。
dHm=Cp,mdT=75.0×(393-373)=1500 [J/mol]
参考文献:Peter Atkins, アトキンス 物理化学(上) 第10版, p.81, (2017)
[A] (2)マクスウェルの速さ分布に関する質問
①V=√(2RT)/M :誤解がないように{(2RT)/M)}^(1/2)である, ②b) 475 m/s,
③まず、マスクウェルの速度分布を用いて<v2>を導出し、その後平均の運動エネルギーの式「![]() 」に代入することで計算できる。平均速さ<vn>は、分布関数の重みとしてvnを積分することで得られる。
」に代入することで計算できる。平均速さ<vn>は、分布関数の重みとしてvnを積分することで得られる。
![]()
2乗平均速さ<v2>はn=2のときの計算を行うことで算出できる。

得られた式を用いて、平均の運動エネルギーは以下のように計算する。

④下図の条件で気体分子が壁に与える圧力を計算し、気体の状態方程式に代入する。


⑤④式中に無理やり運動エネルギー「![]() 」の式を作る。
」の式を作る。

問題中にあるM/R=m/kの関係を見逃さないこと。R=Mk/mである。
解説:
①f(v)が最大値をとるのは極値を取るときであるから、f(v)を微分してf' (v)=0を計算する。

②単位に気を付けながら、与えられている式に値を代入する。

<単位について>

③, ④, ⑤解答と同様。
[B] (1) 水素原子の電子軌道に関する設問
① a) シュレディンガー, b)主, c)方位, d)磁気, e)n, f)l
② a)以下に図示する。 b)余緯度0≤θ≤π、方位角0≤ϕ<2π, ③P(r)=r2 R(r)2, ④C

解説:
①a) 量子力学(粒子=波)による現象(原子の安定性)の記述。確率を表す波が満たす方程式をシュレディンガー方程式という。
①b)~f) 波動関数は電子のふるまいをすべて表現している。電磁の状態を決めるものとして「量子数」があった。
主量子数(n):電子分布の原子核からの大まかな距離。=電子殻の広がり(K殻, L殻…)
方位量子数(l):電子分布の大まかな形状を示す。=副殻の形(s軌道, p軌道, d軌道…)
磁気量子数(m):電子分布の形状を示す。=副殻の角度方向に関する形/副殻は縮重するものもある(ex. p軌道はpx, py, pzと三つある)。それぞれを分別している。
② a)3次元的な座標を表すにあたって、直角座標(x, y, z)と極座標(r, θ, ϕ)があった。波動関数では後者を用いて電子の分布を記述している。導き方は下図参照

② b)各角度の範囲は地球儀を考えるとわかり易い。緯度=θ(天頂角, 極角), 経度=Φ(方位角)である。二つの角で地球のすべての地点を示すことを考えよう。つまり下図のようになる。

③動径分布関数P(r)は半径rの殻のどこかで電子を見出す確率密度。
波動関数ψがψ=RYで表されるとき確率密度は|ψ|2=|RY|2であり、体積素片dτにおいて電子を見出す確率は|RY|2 dτとなる。これは密度(1/体積)×体積によって無次元の確率が得られると解釈する。指定された半径において任意の角度に電子を見出す確率は、その任意の領域全体で積分して求める。

④動径波動関数は「主量子数(n)」と「方位量子数(l)」に依存する。

参考文献:若松寛, 5.5動径分布関数, Accessed:2021/08/02
[B] (2) 多電子原子に関する設問
①パウリの排他原理
②2p軌道は動径波動関数が動径r=0において0になるのに対し、2s軌道は有限の値を示す。これは2s軌道が2p軌道に比べて1s電子による遮蔽効果が小さく、電子がより高い確率で貫入できることを表している。従って2s軌道の方が強い有効各電荷を有するため安定化する。
③a)O:(1s)2(2s)2(2px)2(2py)1(2pz)1, b)フント則
解説:
①フントの規則と混乱しないように。排他という部分で区別できると思う。
パウリの排他原理…ある軌道は最大で2つまでの電子を収容でき、もし1つの軌道に2つの電子が収容されるとき、その電子は互いに対になっていなくてはならない。
※言い換えると全く同じ量子状態(主, 方位, 磁気, スピン)の電子は存在しえないという原理。電子はフェルミ粒子であるためにスピン量子数が(+1/2, -1/2)しか取れない。そのため1つの軌道の電子収容数は最大2
②解答と同様
③考え方を以下に示す。

参考文献:静岡県立大学薬学部・薬学研究院, 原子の基本的構造, 原子の電子配置に関する問題, Accessed:2021/08/02
キャンパスメンバーズの特典を使って博物館・美術館の展示を見てきました!
東工大 物質理工学院 材料系 H30年度(31大修) I-04 無機化学1

【1】東京工業大学大学院 物質理工学院の過去問を自身の勉強のために解いたものです。
【2】必ずしも解答を保証するものではありせん。間違いがある場合があります。
【3】過去問は各自で手に入れてください。
- [A] (1)水溶液中の[Cr(H2O)6]3+と[CrO4]2-について
- [A] (2)炭素とケイ素に関する問
- [B] (1) PtCl2(NH3)2の組成を持つ、異性体関係の白金錯体A~Dの構造式推定
- [B] (2)カルボニル錯体に関する選択穴埋め問題
[A] (1)水溶液中の[Cr(H2O)6]3+と[CrO4]2-について
①[Cr(H2O)6]3+:酸化数+3/d3, [CrO4]2-:酸化数+6/d0
②[Cr(H2O)6]3+は(t2g)3(eg)0のd3電子配置よりスピン許容ではあるが、ラポルテ禁制の(内の一つである)d-d遷移であるため吸収強度は高くない。一方[CrO4]2-はd0錯体であることから電荷移動遷移(特にLMCT遷移)であり、d-d遷移と比べて強い吸収強度を持つ。
解説:
①以下に考え方を示す。

②光吸収がどのように起きるかが、吸収強度に影響する。各遷移について示す。
スピン許容:電子スピンの向きを変えずとも遷移できる(制約を受けない)状態にあること。一方、電子スピンの向きを変える必要がある場合、スピン禁制という。
※スピン禁制の例:八面体でのd-d遷移において低エネルギーのt2g軌道から高エネルギーのeg軌道に対して遷移が起きるとき、既にeg軌道に電子が収容されている場合。
=遷移して上がってきた電子は対を作る必要性からスピンの向きを逆転させなければならない(制約を受ける)ことがある。この状態をスピン禁制という。

ラポルテ禁制:対称中心を持つ分子(八面体錯体など)において、s-s, p-p, d-dのように同じ軌道(対称性がかわらない軌道)に対して遷移が起こる場合に適用され、中程度の吸収強度を持つ。
※四面体錯体は対称中心を持たないため適用不可、より強い吸収を持つようになる。
電荷移動遷移(CT遷移)…配位子Lから中心金属M、あるいはMからLなど異なる原子間での電子移動を伴う遷移。d0では中心金属d軌道に電子がないことを表しているため、遷移ではLからMへと電子移動する。
吸収の強さ:スピン禁制<ラポルテ禁制<ラポルテ許容<電荷移動遷移
[A] (2)炭素とケイ素に関する問
①以下に示す。

②a)下図に示す。b)CO2の共有結合エンタルピーはO=C=Oが1612 [kJ/mol]、網目構造が1436 [kJ/mol]であるためO=C=O構造の方が安定する。一方でSiO2はO=Si=Oが1284 [kJ/mol]、網目構造が1864 [kJ/mol]であるため網目構造の方が安定する。状態に関して、CO2は分子間力しかもたないため、室温では固体を維持できず気体となり、SiO2は共有結合をもつため固体を維持できる。

解説:
①解答のとおり
②a)以下に理由を示す。
・CO2分子の構造予測はルイス構造を記述するとわかりやすい。VSEPR則に則り考える。結果CO2はAX2E0構造であることから直線型(sp混成軌道)。
※A:中心金属, X:配位子, E:中心原子を取り囲む孤立電子対の数
・SiO2は(2)b)の解答が理由。
※SiO2は共有結晶の組成式(Si:O=1:2)であって分子式でないことに注意。図にはないが、SiO4四面体の頂点にあるO原子の先にはSi原子がおり、O原子は2つのSi原子でシェア(半分こに)されている。一つのSi原子に4つのO原子が結合するので、正味O原子は2個である。つまり組成式はSiO2。
②b)共有結合エンタルピーとは名の通り共有結合の強さを表す。従って大きい値である程結合が切れづらく、安定であることが推測できる。表の共有結合エンタルピーを用いて各構造の共有結合エンタルピーを計算し、安定性を比較する。

[B] (1) PtCl2(NH3)2の組成を持つ、異性体関係の白金錯体A~Dの構造式推定

解説:
A:1,2-ジアミノエタン(en)という二座配位子と反応することから、白金触媒のcis体が至適である。PtCl2(NH3)2が持つ2つの-NH3とenが置換反応を起こす。
※Aの構造はシスプラチンといい、反応生成物Dと同様、抗腫瘍活性(腫瘍の増殖を抑制する)がある。
B:1,2-ジアミノエタン(en)という二座配位子と反応しなかったとある。trans体のPtCl2(NH3)2だと-NH3どうしが遠すぎてenが配位できない。
C:問題文通り、イオン対を作図する。イオンの価数については、2つのPtにNH3(中性配位子)×4とCl-(アニオン性配位子)×4が配位しているのでPtの価数をxとして以下のように計算する。
2x+0×4+(-1)×4=0 → x=+2
Ptが2+なので図のようなイオン対となる。この塩はMagnus' green saltと呼ばれ、一次元構造を取る面白い材料。
D:Aの解説と同様。
[B] (2)カルボニル錯体に関する選択穴埋め問題
①ア)0, イ)三方両錐, ウ)-2, エ)18, オ)四面体
②各錯体は配位子COによるπ逆供与によってC≡O結合が弱く(長く)なるが、中心金属に電子供与性配位子(PPH3 etc.)が配位している[Fe(CO)3(PPh3)2]の方がπ逆供与の効果が強く、C≡O結合はさらに弱くなる。伸縮振動数は結合が強い程大きくなるので、[Fe(CO)5]の方が伸縮振動数が大きい。
③生成物を下図に示す。

解説:
①以下に解説を示す
ア):-COは中性配位子であるので、Feは0価。
イ):Feは8族の元素であり、かつ0価であるのでd電子数は8である。
VSEPR則において[Fe(CO)5]はAX5E0であるため三方両錐形。
※5配位錯体の構造には主に三方両錐形と四角錐形があり、混成軌道は前者がsp3dz2 , 後者がsp3dx2-y2である。これらの構造はエネルギー的にほとんど差がなく両方の構造を取るもの([Na(CN)5]3-など)もあるため、構造の推定が困難。主な奴の構造は覚えておくのもいいかもしれない。
ウ):Na2[Fe(CO)4]におけるFeの価数はNa22+ [Fe(CO)4]2-とみると分かりやすく、中性配位子COは価数に関係ないのでFe(-2)となる。
エ):Feは8族の元素であり、かつ-2価であるのでd電子数は10。錯体の価電子数は電子対供与体法を用いて中心金属の10個と配位子の2×4で18電子。
オ):4配位においてd10錯体はsp3混成軌道しか取り得ないので四面体構造。
※四配位錯体には四面体構造を取るsp3, sd3混成軌道と、平面四角構造を取るsp2d混成軌道があるが、d10である場合、中心金属d電子がd軌道に10個収容されなければならないので、d軌道はまるまる5個残っている必要がある。したがって混成軌道にd軌道を含まないsp3混成軌道である。
②配位子C≡Oはπ受容性を持つため、π逆供与(中心金属から配位子π*軌道へd電子が供与されること)が起き、中心金属との結合強さ(長さ)が変わる。つまり振動数も変わる。従ってπ逆供与の効果の強弱を比較することで解を導く。
・π逆供与はM→Lへの供与なのでMに電子供与質が付いているとより電子を送りやすくなり、π逆供与が強くなる。=M-C結合が強く短くなる。
・π逆供与が大きく、M-C結合が強くなるほど、-COのC≡O結合は弱く長くなる。
・CO伸縮振動数はC≡Oが弱くなるほど小さくなる。=π逆供与が強い程振動数が小さくなる。
③アルキル錯体ができるので、アルキル基(-R)の位置に注意して幾何異性体を作図する。
参考文献:名古屋大学, 赤外分光法の基本原理, Accessed:2021/07/28
東工大 物質理工学院 材料系 H29年度(H30年度用想定問題) II-10 熱力学

【1】東京工業大学大学院 物質理工学院の過去問を自身の勉強のために解いたものです。
【2】必ずしも解答を保証するものではありせん。間違いがある場合があります。
【3】過去問は各自で手に入れてください。
(1)熱サイクルに関する穴埋め選択問題
①ウ:カルノーサイクル、②カ:2→3、③ケ:熱、④キ:3→4、⑤シ:温度、⑥コ:仕事、⑦ケ:熱
解説:
①PVグラフや問題文から等温過程と断熱過程の組み合わせによる熱サイクルであることが分かるため。
②断熱膨張過程ではdQ=0であるために、熱力学第一の法則(dU=dQ+dWin)はdU=dWinと整理できる。加えてdU∝dTであるので仕事(の符号/膨張か圧縮か)によって温度は増減することがわかる。膨張仕事は外界に対する仕事であるのでWinは負であり(つまりWout)、温度は減少する。従って等温過程のTLからTHを結ぶようなPV曲線となる。
※カルノーサイクルの向き:1→2→3→4→1です。逆向きは逆カルノーサイクルです。
③断熱しているので熱の移動ができない。
④等温過程はT=const. 従ってPとVの関係は気体の状態方程式(PV=nRT)より反比例(P∝1/V)であることが分かる。y=1/xのようなPV曲線になる。加えてTが大きいとPVも大きくなるのでグラフ上側が高温(TH)での等温過程、下側が低温(TL)での等温過程となる。加えて圧縮過程なので体積が減少する3→4が答え。
⑤等温の字のごとく、温度は一定。
⑥等温圧縮過程より圧縮という仕事が与えられている。
⑦内部エネルギーは温度の関数であり、「dU∝dT」の関係を持つ。等温過程でT=const.ということは内部エネルギーは変化しないということ。熱力学第一の法則「dU=dQ+dWin」見ると、圧縮という仕事が(Win)が与えられている場合、熱は放出されることがわかる。
(2)サイクル過程における仕事とサイクル全体の熱効率を求める
①W12=nRTH×ln(V2/V1), ②W23=CV(TH-TL), ③η=1-(TL/TH)
解説:
①等温膨張過程の仕事はPV=nRTを用いて以下のように計算できる。
![]()
②断熱過程ではdU=dWinであるのに加えて、内部エネルギーは定積熱容量CVを用いてdU=nCVdTと記述できる。膨張仕事は外界への仕事(dWout)であることを考慮すると、以下のよう仕事が求められる。
![]()
③熱効率(η)とは「外界から与えられた熱」でどれだけ「仕事」したかであるので、以下で与えられる。
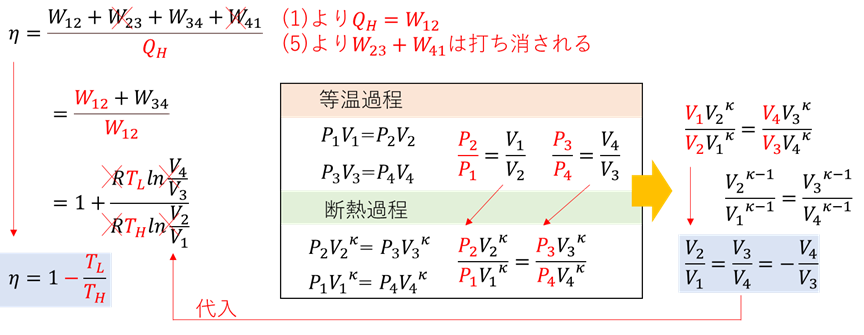
上図のように断熱過程、等温過程におけるPVの関係を用いて体積比の関係を導出し、代入する。
※ポアソンの式(断熱過程における関係式)には下の関係もある。

※ポアソンの式の導出過程を以下に示す。

参考文献:
・高校数学の美しい物語, 断熱変化におけるポアソンの式の導出, Accessed:2021/07/30
・東大塾長の理系ラボ, 熱サイクルと熱効率の超解説, Accessed:2021/07/01
東工大 物質理工学院 材料系 H29年度(H30年度用想定問題) II-05 無機化学

【1】東京工業大学大学院 物質理工学院の過去問を自身の勉強のために解いたものです。
【2】必ずしも解答を保証するものではありせん。間違いがある場合があります。
【3】過去問は各自で手に入れてください。
- (1) 14族元素である炭素やケイ素、鉛などに関する穴埋め問題
- (2)単体で互いに原子配列が異なる物質の呼称と炭素における同素体
- (3)ダイヤモンドにおける単位格子中の原子数、密度の計算
- (4)グラファイトからダイアモンドを製造する条件
- (5)グラファイトにイオンが入り、層間方向に対応する面間隔dが広がる時の回折角の変化
- (6)標準状態におけるCとSiの二酸化物の構造が異なる理由
- (7)太陽電池の原理とバンドギャップ(bg)を狭めることによる効果
- (8)鉛蓄電池の放電反応式と可逆電池としての起電力を求めよ
(1) 14族元素である炭素やケイ素、鉛などに関する穴埋め問題
①sp3混成, ②高い, ③グラフェン, ④sp2混成, ⑤3, ⑥π, ⑦カテネーション, ⑧半導体
解説:
①問題に与えられた図をみるとダイヤモンドの配位数は4で正四面体構造が見て取れる。このことからsp3混成軌道(s,p×3による4つの等価な軌道)を形成している。
炭素Cは原子番号6であり、電子配置「(1s)2(2s)2(2p)2」もしくは電子殻の配置「K2L4」から価電子を4つ(4本の手を)持つ。この4本の手を全てσ結合に使うのがダイヤモンドである。sp3混成軌道はσ結合を形成する電子対どうしの反発により、4配位において空間的に最も遠ざかる四面体構造を取る。
※σ結合:二つの核を結ぶ直線に対して円筒状の対称性を持ち、結合軸周りの軌道角運動量0の結合。
②sp3混成軌道はCの価電子全てを結合につかうため、電子が移動しにくい。
③名称は覚えるしかない。炭素のシート(平面的な構造)がキーワード。
④平面がキーワード。sp2混成軌道は1つのs軌道と2つのp軌道(px, py)を混成して得られる3つの等価な結合である。電気的な反発を抑えるために結合角120°でかつ平面構造を取る。
⑤sp2混成軌道で3つの炭素Cとつながっているため、最近接原子の数は3個。
⑥sp2混成軌道の形成に使われなかったpz軌道(Z軸方向に広がるp軌道)どうしの結合は、原子核を結ぶ軸を180°回転させると元に戻る1単位の軌道角運動量を持つπ結合である。
⑦カテネーションは同種元素の原子が長鎖状に結合することを指す用語であり、炭素Cやケイ素Siの他にも硫黄SやセレンSeなど、限られた元素にのみ見られる。
炭素Cに対して、ケイ素Siではカテネーションが起こりずらいのはC-C結合やC-H結合に比べて、Si-Si結合の結合エンタルピーが弱いためである。
⑧p型, n型などのキーワードより連想は容易。
p型半導体:アクセプタ原子を添加→正孔がキャリアとなる。
n型半導体:ドナー原子を添加→電子がキャリアとなる。
(2)単体で互いに原子配列が異なる物質の呼称と炭素における同素体
解説:
各炭素の同素体の構造、性質を示す。

※同位体:原子核中の陽子数は同じだが中性子数が異なる核種を互いに同位体という。
参考文献:技術情報館SEKIGIN, 物質の構造, Accessed:2021/06/23
(3)ダイヤモンドにおける単位格子中の原子数、密度の計算
原子数:8, 密度:3.42 g/cm3
解説:
ダイヤモンドの単位格子は下図のように見ることができ、

「頂点の原子数+面中心の原子数+丸ごと入っている原子=単位格子中の原子数」
(1/8)×8+(1/2)×6+4=8
と数えられる。次いで密度ρは以下のように計算できる。

じつは、ダイヤモンド構造は閃亜鉛鉱型と同じ形をしている。閃亜鉛鉱型はMX(陽性、陰性元素)を有するのに対してダイヤモンドはC一種類なので異なることに注意すること。あくまで同じなのは原子の配置。
参考文献:化学のグルメ, ダイヤモンドと黒鉛の違い(性質や構造など), Aceessed:2021/06/25
(4)グラファイトからダイアモンドを製造する条件
グラファイトとダイヤモンドのモル体積Vmは密度の大小関係からVm (dia)<Vm (gra)であることがわかる。グラファイトからダイヤへの相転移に伴うギブズエネルギー変化は∆Gm=+2.9 kJであるからdG=VdP-SdTの関係を用いて、高圧条件が必要(不安, 不完全)。
※結合状態についての言及はわかりませんでした。
解説:
1. 標準状態ではダイヤモンドになるのか
グラファイトからダイヤモンドへのギブズエネルギー変化は標準状態(25℃, 1arm)で以下のように計算できる。
dG(gra→dia)=G(dia)-G(gra)=+2.9 [kJ/mol]
dG>0であることから、標準状態において相転移は見込めないことが分かる。
2. 圧力について考える
ギブズエネルギーG=G(圧力P,温度T)であるので、温度一定の時はG(P)となる。

この時、相転移を引き起こすには平衡状態dG(gra→dia)=0となる必要があるので、そうなる圧力を計算する。
圧力変化後のブズエネルギーは温度一定のとき、上式を用いて以下のように表せる。
![]()
物質の体積が圧力によらない定数とすると次式を導くことができる。
![]()
ここで、上の式を見てわかるようにグラファイトとダイヤモンドの体積が必要である。(3)の答えと与えられた密度を用いてモル体積を計算する。

これを用いてdG(gra→dia)=0の条件は以下のようになる。

つまり高圧条件が必要。これはモル体積がグラファイトの方が大きい(密度が小さい)ためである。
(5)グラファイトにイオンが入り、層間方向に対応する面間隔dが広がる時の回折角の変化
ブラッグの式(2dsinθ=nλ)より、面間隔dが広がるとθが小さくなる。
参考文献:IBIDEN株式会社HP, X線回折法の原理, Accessed:2021/08/03
(6)標準状態におけるCとSiの二酸化物の構造が異なる理由
Siは原子半径が大きいため、π軌道の重なりがCと比べて小さい。従って多重結合を形成しづらくsp3混成軌道になり、SiO2は四面体構造を形成する。一方Cはπ軌道の重なりが大きく、多重結合を形成できるためsp混成軌道を形成し直線構造となる。
(7)太陽電池の原理とバンドギャップ(bg)を狭めることによる効果
原理:太陽電池ではpn接合で生じた空乏領域に光が当たると、電子とホールを生じ、起電力によって外部回路へと電流が流れる。
bg狭める効果:利用できる波長範囲が広がる
参考文献:Jasco HP, 太陽電池関連分析技術 バンドギャップ測定, Accessed:2022/05/25
(8)鉛蓄電池の放電反応式と可逆電池としての起電力を求めよ
放電反応式:2PbSO4+2H2O→PbO2+Pb+2H2SO4 , 起電力:2.04 [V]
解説:
1. 反応式について

2. 起電力について
放電の反応式と与えられている各物質の標準生成ギブズエネルギーより、起電力Eは以下のように計算できる。

※鉛蓄電池は放電だけでなく、充電ができる「二次電池」。ボルタ電池やダニエル電池は放電しかできないため「一次電池」。
参考文献:Try IT, 5分でわかる!鉛蓄電池の極板での反応, Accessed:2021/08/03
東工大 物質理工学院 材料系 H29年度(H30年度用想定問題) I-04 無機化学

【1】東京工業大学大学院 物質理工学院の過去問を自身の勉強のために解いたものです。
【2】必ずしも解答を保証するものではありせん。間違いがある場合があります。
【3】過去問は各自で手に入れてください。
- (1) ①水溶液中Cu2+とNH3の錯体形成反応における全安定度定数算出
- (1) ②[Cu(trien)]2+と[Cu(NH3)4]2+において前者の全安定度定数が大きい理由
- (1) ③[Cu(H2O)6]2+についての穴埋め問題
- (1) ④[Cr(H2O)6]3+が置換不活性になる理由
- (2) ①遷移金属錯体の立体構造と中心金属の価電子数
- (2) ②オレフィン配位子の内C-C結合が長いのはどちらか
- (2) ③η4-配位したブタジエン配位子に関する設問
(1) ①水溶液中Cu2+とNH3の錯体形成反応における全安定度定数算出
全安定度定数:logβ1=4.28, logβ2=7.84, logβ3=10.74, logβ4=12.92
解説
全安定度定数βと逐次安定度定数Kとの間にはβn=K1×K2×K3×…Knの関係がある。
つまり、次数ぶんの逐次安定度定数の積となる。
従って、各全安定度定数βの対数値は以下のように計算できる。
logβ1=logK1=4.28
logβ2=log(K1×K2)=logK1+logK2=7.84
lobβ3=log(K1×K2×K3)=logK1+logK2+logK3=10.74
logβ4=log(K1×K2×K3×K4)=logK1+logK2+logK3+logβ4=12.92
(1) ②[Cu(trien)]2+と[Cu(NH3)4]2+において前者の全安定度定数が大きい理由
[Cu(NH3)4]2+ではNH3が単座配位子なのに対して[Cu(trien)]2+はtrienが多座(二座)配位子であることから、キレート効果によって安定化する。
解説:
キレート効果とは、多座配位子によって形成された錯体(キレート錯体)が単座配位子を持つ錯体と比べて安定化する効果をいう。安定化の原理には速度論的なものと熱力学的なものがあり、前者は片方の配位座が固定されることによる実効濃度の上昇、後者は配位数の減少によるエントロピーの増大(ギブズエネルギーの減少)に起因する。
※速度論的効果に関しては、下図のように片方が反応したらもう一方も確実に反応できる(片方が外れても再結合できる)という考え方でいいと思う。

(1) ③[Cu(H2O)6]2+についての穴埋め問題
(a)長く, (b)ヤーン・テラー歪み, (c)d9, (d)dx2-y2, e)1, f)3dz2, g)2, h)静電反発
解説:
八面体構造では、中心金属のeg軌道(dx2-y2 , 3dz2)と配位子が接近するため、静電反発を生じる。静電反発の大きさは軌道に収容される電子数によって異なり、電子収容数が多いと反発により中心金属と配位子間の距離が長くなる。下図のようにdz2軌道に2つの電子が収容される[Cu(H2O)]2+ではZ軸方向に長くなる。

※ヤーンテラー歪みは八面体錯体においてeg軌道に奇数個の電子が収容される元素(d4/高スピン, d7/低スピン, d9)で起きやすい。

※dz2軌道から電子が収容されるのは、その方が全体的に安定化するかららしい。
(1) ④[Cr(H2O)6]3+が置換不活性になる理由
置換反応における解離はeg軌道に電子が収容されている場合に促進し、会合はt2g軌道に空きが存在する場合に促進される。Cr3+はd3であり、(t2g)3(eg)0であるので置換不活性となる。
解説:
八面体錯体において解離時はeg軌道に電子が存在すると配位子電子と反発して解離性が上昇し、会合時はt2gに電子の空きがあることで求核攻撃がしやすくなる。
(2) ①遷移金属錯体の立体構造と中心金属の価電子数

解説:
価電子数は電子対供与体法で考える。(異なる方法として中性配位子法がある)
a)Pd(原子番号46, 2+)で10族元素より、d電子は8(d8)である。加えて化学式より4配位であることから平面四角構造(sp2d混成軌道)を取ることで電子配置的な安定化を得ていることが予測される。
※平面四角構造(sp2d混成軌道)を取ると、中心金属d電子を収容できるd軌道が4つ(配位子との結合に使われるsp2d混成軌道にd軌道が1つ使われているため)になるので、電子収容可能数は8になる。d8錯体であれば軌道を満たすことができるため、電子配置的な安定化の効果で特に平面四角構造をとりやすい。
価電子数については、電子対供与法を用いて、中心金属Pd(2+)から電子8、配位子Cl-から2, PPh3から2ずつより16電子
b)Pd(原子番号46, 0)で10族元素よりd10である。4配位であるので正四面体構造(sp3混成軌道)になる。
四配位錯体には四面体構造を取るsp3, sd3混成軌道と、平面四角構造を取るsp2d混成軌道があるが、d10である場合、中心金属d電子がd軌道に10個収容されなければならないので、d軌道はまるまる5個残っている必要がある。したがって混成軌道にd軌道を含まないsp3混成軌道であることが予測される。
価電子数は、中心金属Pd(0)から電子10、配位子PPh3から2個ずつ(計8個)で合計18電子
c)6配位錯体の構造としては八面体構造があり、mer, facという(cis, trans的な)異性体がある。
fac, mer異性体はそれぞれ八面体の6個の頂点の内、3個の位置関係を示すもので、facは3個の配位原子が一つの3角面を占めているものであり、merは3個が八面体の子午線上に並ぶものである(つまり同一平面状)。
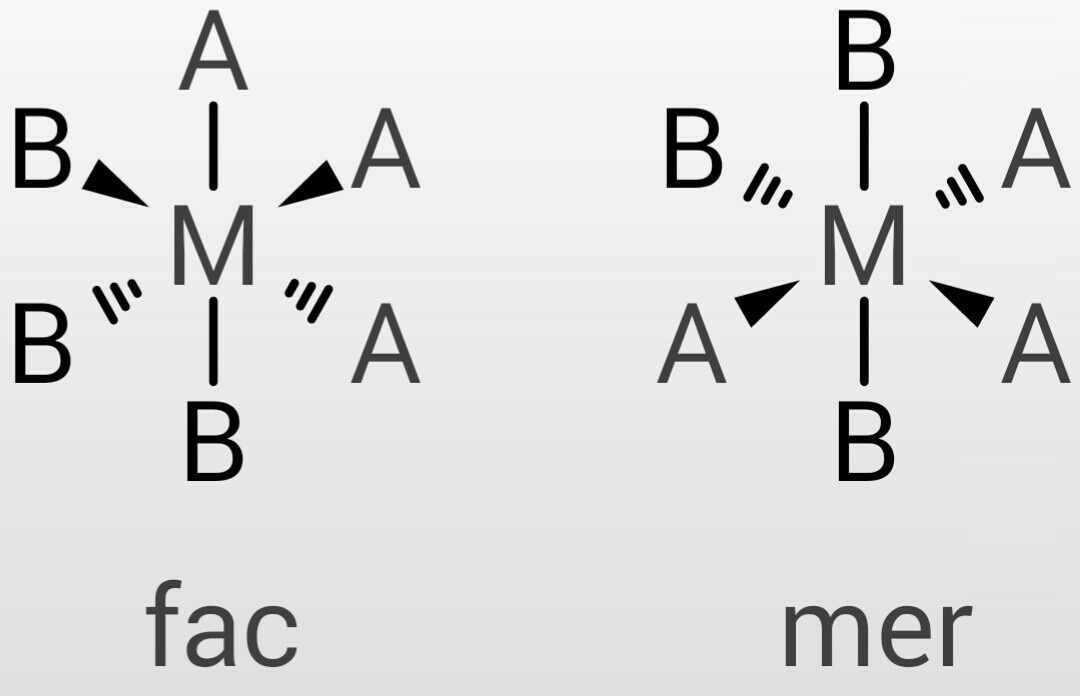
価電子数は、中心金属はMo(+3)で第6族元素より電子3、配位子Cl-から2、NH3から2ずつより、15電子。
d)[Fe(η5-C5H5)2]+はフェロセンの一つで、η(ハプト数/等価に配位していることを示す)より、配位子C5H5のCは5つとも等価に配位している(η5)ことがわかる。それが2個配位していることからサンドイッチ構造になっている。
価電子は、中心金属Fe(3+)から5、配位子C5H5-から6 (5/元からの供与数+1/負電荷分)ずつより17。
参考文献:新村陽一, 無機立体化学の新しい命名法, (1982)
(2) ②オレフィン配位子の内C-C結合が長いのはどちらか
C2F2の方がπ逆供与が強くなるため、Pt-C間の結合は短くなるが、C-C結合は長くなる。
解説:
前提を以下に示す。
・結合が強い程、結合長は短くなる(ex.単結合>2重結合>3重結合)。
・オレフィン配位子(η2-C2F2 , η2-C2H2)はπ逆供与(中心金属から電子を受け取り、2重結合性を帯びる)を受ける。
ここで留意するのは中心金属―オレフィン配位子間の距離はπ逆供与によって短くなるが、反対に配位子のC-C素結合は弱く長くなることである。炭素―炭素結合の長さはπ逆供与の強さで比較できる。
C2F2とC2H2ではF(電気陰性度F>H)を有するC2F2の方が中心金属からの電子を引き付けやすいためπ逆供与が強くなる。従って、η2-C2F2の方が炭素-炭素結合が長い。
参考文献
・化学徒の忘備録, 分光化学系列と配位子の電子供与、逆供与について, Accessed:2021/06/25
・大阪大学工学部, 遷移金属錯体触媒反応を理解するための有機金属化学基礎知識, Accessed:2022/05/24
(2) ③η4-配位したブタジエン配位子に関する設問
a) HOMO:Φ2, LUMO:Φ3
b)以下にブタジエンの分子軌道を示す。

c)dx2-y2
d)C1-C2結合に関しては②同じようにπ逆供与の効果が強くなるため長くなる。またC2-C3について共役二重結合の中心にある単結合は通常の単結合よりも短い状態になるが、π逆供与が進行することによって共役性が薄れC2-C3結合が長くなる(不安)。
解説:
a)分子軌道のエネルギーは節の数によって決まり、多いほどエネルギーが大きくなる。節とは波動関数が0を通過する点であり、位相の逆転が起こる点である。本問では位相を白黒で表している。Φ1は節0, Φ2は節1, Φ3は節2, Φ4は節3であることから、エネルギー準位は「Φ1<Φ2<Φ3<Φ4」となる。ブタジエンのπ電子数は4つなので、エネルギー準位の低い順に電子を収容していくとHOMO(最高被占軌道)はΦ2、LUMO(最低空軌道)はΦ3となる。
b)軌道間の相互作用(結合性軌道)は、同位相での重なりで起きる。金属d軌道とブタジエンの分子軌道(Φ1, Φ2, Φ3, Φ4)が同位相で重なる組み合わせを描く。ブタジエンの方位(xyz軸)は問題で定まっていることに注意。
※Φ4について、dxyはx軸とy軸の間に軌道が突出しているので、x及びy軸上に突出するdx2-y2よりもΦ4との重なりが大きいのではないかと考えている(不安)。
c)相互作用の相手がいないdx2-y2
d)解答と同様
